Termodynamikk ved livets opprinnelse
Brian Miller; 19. juni 2017
Bilde1. Kilde: PublicDomainPhotos.net
 Populære artikler om opprinnelse-til-liv forskning har ofte skildret feltet som stadig avanserende og raskt konvergerende mot en rent materialistisk forklaring til den første autonome cellen. Men den sanne tilstanden er langt annerledes. Høydepunktet av optimisme var faktisk på 1950-tallet da Stanley Millers eksperiment ga flere av livets byggeklosser. Dessverre erkjente geologer senere at gassene som ble brukt i det eksperimentet, ikke stemte overens med kjemien til den tidlige Jorden. Når det ble gjenforsøkt med gassene som faktisk var til stede, produserte eksperimentene få byggeklosser i tilstrekkelige mengder for å bidra til opprinnelse-liv-scenarier. Videre avslører nærmere, moderne undersøkelser av forsøk på å syntetisere livets forløpere, at dannelsen av mange av dem på den tidlige jorden er praktisk talt umulig -her ,i betydelige mengder. Men den mer grunnleggende utfordringen med termodynamikk overskygger selv disse hindrene.
Populære artikler om opprinnelse-til-liv forskning har ofte skildret feltet som stadig avanserende og raskt konvergerende mot en rent materialistisk forklaring til den første autonome cellen. Men den sanne tilstanden er langt annerledes. Høydepunktet av optimisme var faktisk på 1950-tallet da Stanley Millers eksperiment ga flere av livets byggeklosser. Dessverre erkjente geologer senere at gassene som ble brukt i det eksperimentet, ikke stemte overens med kjemien til den tidlige Jorden. Når det ble gjenforsøkt med gassene som faktisk var til stede, produserte eksperimentene få byggeklosser i tilstrekkelige mengder for å bidra til opprinnelse-liv-scenarier. Videre avslører nærmere, moderne undersøkelser av forsøk på å syntetisere livets forløpere, at dannelsen av mange av dem på den tidlige jorden er praktisk talt umulig -her ,i betydelige mengder. Men den mer grunnleggende utfordringen med termodynamikk overskygger selv disse hindrene.
Vanlige argumenter om livets opprinnelse har tradisjonelt fokusert på usannsynligheten for at livet dannes ved en tilfeldighet. Kanskje det mest kjente: fysikeren Fred Hoyle beregnet sannsynligheten for at en celle-forening skulle være omtrent 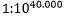 (1 til 10 opphøyd i 40.000). Han sammenlignet denne sannsynligheten med sjansene for at en tornado pløyde gjennom en søppelplass og dannet et jetfly. Begrepet sannsynlighet er nært knyttet til entropi, siden sannsynligheten er proporsjonal med antall konfigurasjoner(N), der noen tilstand kan oppstå, og entropi er proporsjonal med log(N) -her. For eksempel vil antall måter vannmolekyler kan ordne seg i fast tilstand, være mye lavere enn antall måter i væske- eller gasstilstander, så is er tilstanden med lavest entropi (uorden). På grunn av denne sammenhengen blir sannsynlighetsargumentet ofte omtalt som at naturen har en tendens til å bevege seg fra tilstander med lavere entropi til høyere entropi, noe som ganske enkelt betyr at naturen beveger seg mot tilstander som er meget sannsynlige. Denne tendensen er kjent som termodynamikkens andre lov.
(1 til 10 opphøyd i 40.000). Han sammenlignet denne sannsynligheten med sjansene for at en tornado pløyde gjennom en søppelplass og dannet et jetfly. Begrepet sannsynlighet er nært knyttet til entropi, siden sannsynligheten er proporsjonal med antall konfigurasjoner(N), der noen tilstand kan oppstå, og entropi er proporsjonal med log(N) -her. For eksempel vil antall måter vannmolekyler kan ordne seg i fast tilstand, være mye lavere enn antall måter i væske- eller gasstilstander, så is er tilstanden med lavest entropi (uorden). På grunn av denne sammenhengen blir sannsynlighetsargumentet ofte omtalt som at naturen har en tendens til å bevege seg fra tilstander med lavere entropi til høyere entropi, noe som ganske enkelt betyr at naturen beveger seg mot tilstander som er meget sannsynlige. Denne tendensen er kjent som termodynamikkens andre lov.
 Slike argumenter lyder imponerende først, men de er faktisk ufullstendige. Nesten alle forskere innser at den første cellen ikke kunne ha kommet ved en tilfeldighet. De tror i stedet at noen fysiske prosesser bidro til å slå oddsen. Som en analogi kan man aldri slå tusen seksere på rad med rettferdig terning. Men hvis terningene ble 'fikset', kunne dette resultatet være ganske sannsynlig, eller til og med nær garantert. Analogt beveger noen systemer faktisk fra tilstander med høyere entropi til de av lavere entropi (dvs. tilsynelatende lav sannsynlighet) hvis de lavere entropi-tilstandene er 'fikset' til å forekomme. Et slik avvik er skapt av en annen drivende kraft. Naturen nemlig har en tendens til å bevege seg fra tilstander med høyere energi til de med lavere energi. For eksempel ruller steiner nedoverbakke, siden lavere høyde tilsvarer lavere høydeenergi. På samme måte tiltrekker vannmolekyler hverandre, så isen er i en lavere energitilstand siden vannmolekylene i gjennomsnitt er nærmere hverandre enn i væske- eller gasstilstandene. Ved lave nok temperaturer overvinner denne tiltrekningen tendensen til å bevege seg mot høyere entropi, som resulterer i vannfrysing.
Slike argumenter lyder imponerende først, men de er faktisk ufullstendige. Nesten alle forskere innser at den første cellen ikke kunne ha kommet ved en tilfeldighet. De tror i stedet at noen fysiske prosesser bidro til å slå oddsen. Som en analogi kan man aldri slå tusen seksere på rad med rettferdig terning. Men hvis terningene ble 'fikset', kunne dette resultatet være ganske sannsynlig, eller til og med nær garantert. Analogt beveger noen systemer faktisk fra tilstander med høyere entropi til de av lavere entropi (dvs. tilsynelatende lav sannsynlighet) hvis de lavere entropi-tilstandene er 'fikset' til å forekomme. Et slik avvik er skapt av en annen drivende kraft. Naturen nemlig har en tendens til å bevege seg fra tilstander med høyere energi til de med lavere energi. For eksempel ruller steiner nedoverbakke, siden lavere høyde tilsvarer lavere høydeenergi. På samme måte tiltrekker vannmolekyler hverandre, så isen er i en lavere energitilstand siden vannmolekylene i gjennomsnitt er nærmere hverandre enn i væske- eller gasstilstandene. Ved lave nok temperaturer overvinner denne tiltrekningen tendensen til å bevege seg mot høyere entropi, som resulterer i vannfrysing.
Bilde 2. Argumenter mot spontan dannelse av liv
Men selv i disse tilfellene med lokalt avtagende entropi, er ikke termodynamikkens andre lov brutt, for endringene er alltid eksotermiske, varme frigjøres. Varmen som forlater det lokale systemet (f.eks. en kopp med frossent vann -her) og inn i det omgivende miljøet, øker sistnevntes entropi med en mengde som er større enn entropi-nedgangen i det lokale systemet. Derfor øker universets totale entropi. Problemet for alle teorier om livets opprinnelse blir nå tydelig. Den enkleste funksjonelle cellen i forhold til de mest grunnleggende bygge-blokkene har både lavere entropi og høyere energi. Og, naturlige systemer reduserer aldri entropi og gir økning i energi samtidig. En slik begivenhet ville være som å rulle utallige seks på rad når terningene er sterkt fikset til å kaste én med. Derfor vil livets opprinnelse gjennom rent naturlige prosesser virke så usannsynlig som at vann på en varm sommerdag spontant fryser eller en elv som flyter uhjulpet oppoverbakke i tusenvis av km.
Fysikere og kjemikere kombinerer ofte entropi og energi (eller entalpi ) sammen i det som kalles den frie energien til et system -her. Forandringen av fri energi er alltid negativ for spontane endringer (f.eks. ved-brenning eller issmelting om sommeren) her, og det er direkte knyttet til den totale økningen i universets entropi.  Utfordringen for livets opprinnelse er da å forklare hvordan milliarder atomer spontant kunne komme sammen til en tilstand av betydelig høyere fri energi. Sjansen for at et slikt tilfelle skjer gjennom termiske svingninger, ble beregnet av biofysikeren Harold Morowitz til å være mindre enn
Utfordringen for livets opprinnelse er da å forklare hvordan milliarder atomer spontant kunne komme sammen til en tilstand av betydelig høyere fri energi. Sjansen for at et slikt tilfelle skjer gjennom termiske svingninger, ble beregnet av biofysikeren Harold Morowitz til å være mindre enn 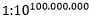 (1 til 10 opphøyd i hundre millioner) -her . Dette tallet kommer direkte fra en estimering av livets frie energi, og fri energi er en sti-uavhengig funksjon. Derfor er dette maksimale sannsynlighetsestimatet ikke meningsfullt avhengig av den teoretiske ruten som førte til livet (f.eks. Protein-først versus RNA-verden) eller på antall trinn involvert. Sannsynligheten er alltid i hovedsak null.
(1 til 10 opphøyd i hundre millioner) -her . Dette tallet kommer direkte fra en estimering av livets frie energi, og fri energi er en sti-uavhengig funksjon. Derfor er dette maksimale sannsynlighetsestimatet ikke meningsfullt avhengig av den teoretiske ruten som førte til livet (f.eks. Protein-først versus RNA-verden) eller på antall trinn involvert. Sannsynligheten er alltid i hovedsak null.
Bilde 3A. DNA-RNA og Proteiner er avhengige av hverandre og Bilde 3B. Det gjelder også deres opprinnelse
 Tilsynelatende ser denne termodynamiske analysen for livets opprinnelse ut til å negere enhver mulig materialistisk løsning på problemet. Men teoretikere har lenge gjenkjent et gjenstående smutthull. Morowitzs beregninger antok at systemet var i en tilstand nær likevekt. For eksempel kan noen lynnedslag ha slått ned i en dam med prebiotiske kjemikalier om natten og forårsaket at atomer kom sammen i forskjellige konfigurasjoner. Dammen vil da raskt resette seg tilbake i en rolig tilstand der temperatur, konsentrasjon og andre variabler ville forbli ganske jevne. Imidlertid hevder mange at livets opprinnelse fant sted i et system som er sterkt drevet bort fra likevekt, slik som en dam som er utsatt for intens solstråling, eller ved bunnen av havet nær en hydrotermisk sjakt, som oversvømmer omgivelsene med overopphetet vann og kjemikalier med høy energi. Slike innstillinger blir ofte referert til som ikke-likevekts-sprednings systemer. Deres felles karakteristikk er at klassisk termodynamikk bryter ned, slik at de tidligere analysene ikke helt holder. I stedet må prinsippene for ikke-likevekts-termodynamikk brukes, som er langt mer komplekse og mindre godt forstått. Dessuten håpet man at energien fra disse ytre kildene skulle muliggjøre at den frie energi-barrieren ble overvunnet.
Tilsynelatende ser denne termodynamiske analysen for livets opprinnelse ut til å negere enhver mulig materialistisk løsning på problemet. Men teoretikere har lenge gjenkjent et gjenstående smutthull. Morowitzs beregninger antok at systemet var i en tilstand nær likevekt. For eksempel kan noen lynnedslag ha slått ned i en dam med prebiotiske kjemikalier om natten og forårsaket at atomer kom sammen i forskjellige konfigurasjoner. Dammen vil da raskt resette seg tilbake i en rolig tilstand der temperatur, konsentrasjon og andre variabler ville forbli ganske jevne. Imidlertid hevder mange at livets opprinnelse fant sted i et system som er sterkt drevet bort fra likevekt, slik som en dam som er utsatt for intens solstråling, eller ved bunnen av havet nær en hydrotermisk sjakt, som oversvømmer omgivelsene med overopphetet vann og kjemikalier med høy energi. Slike innstillinger blir ofte referert til som ikke-likevekts-sprednings systemer. Deres felles karakteristikk er at klassisk termodynamikk bryter ned, slik at de tidligere analysene ikke helt holder. I stedet må prinsippene for ikke-likevekts-termodynamikk brukes, som er langt mer komplekse og mindre godt forstått. Dessuten håpet man at energien fra disse ytre kildene skulle muliggjøre at den frie energi-barrieren ble overvunnet.
Imidlertid gjør slike appeller til ikke-likevektsystemer lite for å løse de grunnleggende termodynamiske problemene. For det første kunne ikke noe system opprettholdes langt fra likevekt i mer enn en begrenset tid. Solen er bare ute om dagen, og overopphetet vann på bunnen av havet vil etter hvert flytte seg bort fra noen hydrotermiske sjakter. Eventuelle fremskritt mot dannelsen av en celle ville gå tapt når systemet vendte seg mot likevekt (lavere fri energi) og dermed bort fra ethver tilstand som nærmer seg livet. For det andre øker inntaket av rå solvarme, termiske eller andre former for energi faktisk entropi av systemet, og dermed beveger den seg i feil retning. For eksempel ville det ultrafiolette lyset fra solen -her, eller varmen fra hydrotermiske sjakter, ha større vanskeligheter med å danne de komplekse kjemiske strukturer som trengs for livet, enn for å bryte dem fra hverandre. Endelig virker forskjellene i temperatur, konsentrasjoner og andre variabler i ikke-likevektsystemer som termodynamiske krefter som driver varmeoverføring, diffusjon og andre termodynamiske strømmer. Disse strømningene skaper mikroskopiske kilder til entropi produksjon -her, som igjen flytter systemet bort fra enhver redusert entropi tilstand assosiert med livet. Kort sagt, de prosesser som forekommer i ikke-likevektsystemer, som i deres nær-likevekts motparter, gjør generelt det motsatte av det som faktisk trengs.
Ansvarlig oversetter Asbjørn E. Lund Populære artikler om opprinnelse-til-liv forskning har ofte skildret feltet som stadig avanserende og raskt konvergerende mot en rent materialistisk forklaring til den første autonome cellen. Men den sanne tilstanden er langt annerledes. Høydepunktet av optimisme var faktisk på 1950-tallet da Stanley Millers eksperiment ga flere av livets byggeklosser. Dessverre erkjente geologer senere at gassene som ble brukt i det eksperimentet, ikke stemte overens med kjemien til den tidlige Jorden. Når det ble gjenforsøkt med gassene som faktisk var til stede, produserte eksperimentene få byggeklosser i tilstrekkelige mengder for å bidra til opprinnelse-liv-scenarier. Videre avslører nærmere, moderne undersøkelser av forsøk på å syntetisere livets forløpere, at dannelsen av mange av dem på den tidlige jorden er praktisk talt umulig -her ,i betydelige mengder. Men den mer grunnleggende utfordringen med termodynamikk overskygger selv disse hindrene.
Populære artikler om opprinnelse-til-liv forskning har ofte skildret feltet som stadig avanserende og raskt konvergerende mot en rent materialistisk forklaring til den første autonome cellen. Men den sanne tilstanden er langt annerledes. Høydepunktet av optimisme var faktisk på 1950-tallet da Stanley Millers eksperiment ga flere av livets byggeklosser. Dessverre erkjente geologer senere at gassene som ble brukt i det eksperimentet, ikke stemte overens med kjemien til den tidlige Jorden. Når det ble gjenforsøkt med gassene som faktisk var til stede, produserte eksperimentene få byggeklosser i tilstrekkelige mengder for å bidra til opprinnelse-liv-scenarier. Videre avslører nærmere, moderne undersøkelser av forsøk på å syntetisere livets forløpere, at dannelsen av mange av dem på den tidlige jorden er praktisk talt umulig -her ,i betydelige mengder. Men den mer grunnleggende utfordringen med termodynamikk overskygger selv disse hindrene. Slike argumenter lyder imponerende først, men de er faktisk ufullstendige. Nesten alle forskere innser at den første cellen ikke kunne ha kommet ved en tilfeldighet. De tror i stedet at noen fysiske prosesser bidro til å slå oddsen. Som en analogi kan man aldri slå tusen seksere på rad med rettferdig terning. Men hvis terningene ble 'fikset', kunne dette resultatet være ganske sannsynlig, eller til og med nær garantert. Analogt beveger noen systemer faktisk fra tilstander med høyere entropi til de av lavere entropi (dvs. tilsynelatende lav sannsynlighet) hvis de lavere entropi-tilstandene er 'fikset' til å forekomme. Et slik avvik er skapt av en annen drivende kraft. Naturen nemlig har en tendens til å bevege seg fra tilstander med høyere energi til de med lavere energi. For eksempel ruller steiner nedoverbakke, siden lavere høyde tilsvarer lavere høydeenergi. På samme måte tiltrekker vannmolekyler hverandre, så isen er i en lavere energitilstand siden vannmolekylene i gjennomsnitt er nærmere hverandre enn i væske- eller gasstilstandene. Ved lave nok temperaturer overvinner denne tiltrekningen tendensen til å bevege seg mot høyere entropi, som resulterer i vannfrysing.
Slike argumenter lyder imponerende først, men de er faktisk ufullstendige. Nesten alle forskere innser at den første cellen ikke kunne ha kommet ved en tilfeldighet. De tror i stedet at noen fysiske prosesser bidro til å slå oddsen. Som en analogi kan man aldri slå tusen seksere på rad med rettferdig terning. Men hvis terningene ble 'fikset', kunne dette resultatet være ganske sannsynlig, eller til og med nær garantert. Analogt beveger noen systemer faktisk fra tilstander med høyere entropi til de av lavere entropi (dvs. tilsynelatende lav sannsynlighet) hvis de lavere entropi-tilstandene er 'fikset' til å forekomme. Et slik avvik er skapt av en annen drivende kraft. Naturen nemlig har en tendens til å bevege seg fra tilstander med høyere energi til de med lavere energi. For eksempel ruller steiner nedoverbakke, siden lavere høyde tilsvarer lavere høydeenergi. På samme måte tiltrekker vannmolekyler hverandre, så isen er i en lavere energitilstand siden vannmolekylene i gjennomsnitt er nærmere hverandre enn i væske- eller gasstilstandene. Ved lave nok temperaturer overvinner denne tiltrekningen tendensen til å bevege seg mot høyere entropi, som resulterer i vannfrysing. Utfordringen for livets opprinnelse er da å forklare hvordan milliarder atomer spontant kunne komme sammen til en tilstand av betydelig høyere fri energi. Sjansen for at et slikt tilfelle skjer gjennom termiske svingninger, ble beregnet av biofysikeren Harold Morowitz til å være mindre enn
Utfordringen for livets opprinnelse er da å forklare hvordan milliarder atomer spontant kunne komme sammen til en tilstand av betydelig høyere fri energi. Sjansen for at et slikt tilfelle skjer gjennom termiske svingninger, ble beregnet av biofysikeren Harold Morowitz til å være mindre enn  Tilsynelatende ser denne termodynamiske analysen for livets opprinnelse ut til å negere enhver mulig materialistisk løsning på problemet. Men teoretikere har lenge gjenkjent et gjenstående smutthull. Morowitzs beregninger antok at systemet var i en tilstand nær likevekt. For eksempel kan noen lynnedslag ha slått ned i en dam med prebiotiske kjemikalier om natten og forårsaket at atomer kom sammen i forskjellige konfigurasjoner. Dammen vil da raskt resette seg tilbake i en rolig tilstand der temperatur, konsentrasjon og andre variabler ville forbli ganske jevne. Imidlertid hevder mange at livets opprinnelse fant sted i et system som er sterkt drevet bort fra likevekt, slik som en dam som er utsatt for intens solstråling, eller ved bunnen av havet nær en hydrotermisk sjakt, som oversvømmer omgivelsene med overopphetet vann og kjemikalier med høy energi. Slike innstillinger blir ofte referert til som ikke-likevekts-sprednings systemer. Deres felles karakteristikk er at klassisk termodynamikk bryter ned, slik at de tidligere analysene ikke helt holder. I stedet må prinsippene for ikke-likevekts-termodynamikk brukes, som er langt mer komplekse og mindre godt forstått. Dessuten håpet man at energien fra disse ytre kildene skulle muliggjøre at den frie energi-barrieren ble overvunnet.
Tilsynelatende ser denne termodynamiske analysen for livets opprinnelse ut til å negere enhver mulig materialistisk løsning på problemet. Men teoretikere har lenge gjenkjent et gjenstående smutthull. Morowitzs beregninger antok at systemet var i en tilstand nær likevekt. For eksempel kan noen lynnedslag ha slått ned i en dam med prebiotiske kjemikalier om natten og forårsaket at atomer kom sammen i forskjellige konfigurasjoner. Dammen vil da raskt resette seg tilbake i en rolig tilstand der temperatur, konsentrasjon og andre variabler ville forbli ganske jevne. Imidlertid hevder mange at livets opprinnelse fant sted i et system som er sterkt drevet bort fra likevekt, slik som en dam som er utsatt for intens solstråling, eller ved bunnen av havet nær en hydrotermisk sjakt, som oversvømmer omgivelsene med overopphetet vann og kjemikalier med høy energi. Slike innstillinger blir ofte referert til som ikke-likevekts-sprednings systemer. Deres felles karakteristikk er at klassisk termodynamikk bryter ned, slik at de tidligere analysene ikke helt holder. I stedet må prinsippene for ikke-likevekts-termodynamikk brukes, som er langt mer komplekse og mindre godt forstått. Dessuten håpet man at energien fra disse ytre kildene skulle muliggjøre at den frie energi-barrieren ble overvunnet.